近日,我校生命科学研究院博士后林萌萌作为共同第一作者,与上海科技大学杨海涛教授、清华大学饶子和院士团队以及哥伦比亚大学何大一(David D. Ho)院士团队等研究人员合作在Nature上发表了题为“Molecular mechanisms of SARS-CoV-2 resistance to nirmatrelvir”的研究论文,揭示了新冠病毒如何利用两种截然不同的途径对治疗药物产生耐药性的分子机制。这是我校科研人员首次以共同一作身份在全球顶级期刊Nature上发表学术成果。

新冠病毒(SARS-CoV-2)肆虐全球,对人类健康乃至社会经济都造成了空前影响,如何开发治疗新冠的特效药是科学家们面临的极具挑战性的科学问题。目前,靶向病毒蛋白酶的药物在抗新冠药物中占有举足轻重的地位,如辉瑞公司(Pfizer Inc.)开发的新冠口服药Paxlovid(nirmatrelvir/ritonavir组合,中译名:奈玛特韦/利托那韦),以及紧急授权使用的盐野义公司(Shionogi & Co., Ltd.)的药物Xocova(ensitrelvir,中译名:恩赛特韦)等,都是靶向新冠病毒主蛋白酶(main protease,Mpro)的抗病毒药物。
随着靶向病毒蛋白酶药物的广泛使用,新冠病毒作为一种高突变的RNA病毒,是否会对Paxlovid中的抗病毒活性成分奈玛特韦产生耐药性?如果存在耐药的风险,我们将如何应对?这些都是备受关注的重要科学问题。
研究团队曾发现,在奈玛特韦的选择压力作用下,新冠病毒可以通过突变其主蛋白酶上的多个位点获得对奈玛特韦的耐药性,但其背后的精确分子机制仍是未解之谜(Iketaniet al.,Nature, 2022)。在本工作中,研究团队综合利用病毒学、生物化学以及结构生物学等多学科交叉手段对以上突变展开研究并发现新冠病毒可以利用两种截然不同的进化途径(如图所示:Evolutionary Routes 1 & 2)对奈玛特韦产生耐药性。
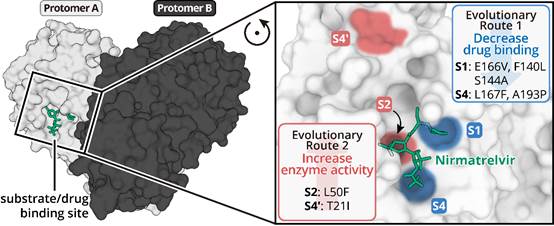
新冠病毒采取两种截然不同的进化途径对临床药物产生耐药性
第一条进化途径涉及主蛋白酶底物结合口袋的S1与S4位点,这些突变可以破坏奈玛特韦与这些位点的结合能力,削弱其对主蛋白酶活性的抑制能力。但该突变也会严重影响病毒自身复制的速率,因此狡猾的新冠病毒同时又进化出第二条进化途径。此途径涉及主蛋白酶底物结合口袋的S2与S4'位点,这些点突变会引起病毒主蛋白酶的活力增加。最终新冠病毒同时采纳两种进化途径,形成双突变,在逃逸抗病毒药物攻击的同时又能够保持自身的复制和传播能力。此外,研究还发现通过这种耐药机制,新冠病毒对恩赛特韦也产生耐药性,这说明该耐药机制很可能具有普适性。
为了寻求解决病毒耐药的办法,研究团队比较了各种小分子抑制剂与新冠病毒主蛋白酶的结合模式,并发现以前报道过的一种天然产物抑制剂具有独特的、与蛋白酶的结合模式。后续测试也表明上述病毒的突变体对该天然产物没有耐药性。研究团队的工作为解决当前抗新冠药物在临床使用中产生潜在耐药性问题,以及开发新一代抗病毒药物奠定了理论基础。
本项工作由重庆医科大学、上海科技大学、哥伦比亚大学、南开大学等多家单位合作完成。重庆医科大学博士后林萌萌、上海科技大学博士研究生段胤凯、硕士研究生周浩、南开大学副研究员刘祥、哥伦比亚大学Sho Iketani博士为论文的并列第一作者。上科大免化所和生命学院双聘教授杨海涛、哥伦比亚大学何大一院士为本论文共同通讯作者。
文章链接:https://www.nature.com/articles/s41586-023-06609-0

